Gaya Antar Molekul dan Ikatan Hidrogen
Halo adik-adik. Pada tulisan kali ini, 5NChemistry akan menjelaskan kepada kalian tentang Gaya antar molekul dan Ikatan Hidrogen. Setelah membaca, kalian diharapkan dapat memahami apa itu gaya antar molekul, faktor-faktor yang mempengaruhinya, serta apa itu ikatan hidrogen dan senyawa-senyawa yang bagaimana yang memiliki ikatan hidrogen. Jadi, langsung saja disimak ya.
1. Gaya Antar Molekul
Dalam kimia, kita mengenal gaya ikatan antar-atom seperti ikatan ion dan ikatan kovalen. Selain ikatan antar-atom, ada juga gaya yang bekerja antar-molekul yang terjadi antar molekul-molekul kovalen. Gaya tarik antar-molekul ini berpengaruh terhadap wujud zat dimana gaya ini akan bekerja efektif bila jarak antarmolekul sudah sangat dekat. Jika molekul-molekul gas dikompresi dan didinginkan, maka jarak antarmolekulnya menjadi lebih dekat sehingga molekul-molekul gas menjadi zat cair, dan jika dan jika semakin dekat lagi, maka gaya antarmolekulnya semakin kuat dan zat cair tersebut bisa menjadi zat padat. Namun, gaya ini sangat lemah jika dibandingkan dengan ikatan antar atom seperti ikatan ion dan ikatan kovalen. Gaya tarik antar-molekul ini dikenal gaya van der Waals, karena memang pertama sekali diteliti oleh Diderick van der Waals (1873).
Gaya van der Waals dibedakan menjadi tiga sebagai berikut.
Baca juga : Bentuk Molekul Senyawa
a. Gaya antardipol/dipol-dipol. terjadi antar sesama molekul polar, seperti antar molekul HCl.
 |
| Gaya antar molekul dipol-dipol |
Hal inilah yang menjelaskan bagaimana ikan dapat bernafas di air. Molekul air yang memiliki dipol permanen mengimbas (menginduksi) molekul O2 yang tidak memiliki dipol. Akibatnya terjadi dipol sesaat pada O2. Pada saat terjadi dipol sesaat tersebutlah terjadi gaya tarik antara molekul polar (H2O) dengan molekul non-polar (O2).
c. Gaya dispersi/gaya London/gaya dipol sesaat terjadi antar sesama molekul non- polar seperti O2 dan H2. Bisa dikatakan gaya ini adalah satu-satunya gaya yang bekerja pada molekul non-polar.
Dipol
sesaat terjadi akibat penyebaran elektron yang tidak merata (elektron bergerak
sangat cepat). Posisi elektron bisa saja mengumpul (padat) disuatu tempat pada
suatu saat yang mengakibatkan posisi itu menjadi dipol negatif dan posisi yang
sepi elektron menjadi dipol positif. Namun, posisi ini juga bisa berubah dengan
sangat cepat, tempat yang tadinya dipol negatif bisa saja berubah menjadi dipol
positif
dan sebaliknya.Kekuatan gaya van
der Waals dipengaruhi oleh dua faktor, yaitu ukuran molekul dan
bentuk molekul (kerumitan).
a) Ukuran molekul
Mari kita lihat molekul-molekul halogen mulai dari F2, Cl2, Br2,
I2. Dari atas kebawah satu golongan jelas jari-jari bertambah,
sehingga ukuran molekul I2 > Br2 > Cl2
> F2. Semakin besar ukuran molekul (Mr-nya semakin besar), maka
akan semakin mudah mengalami dipol sesaat karena elektron-elektronnya jauh dari
inti sehingga dapat bergerak lebih leluasa, akibatnya gaya van der Waals I2
lebih kuat dari molekul-molekul halogen lainnya. Hal ini dapat dilihat dari
wujud, titik didih dan titik lebur halogen. Pada suhu kamar, F2 dan
Cl2 berwujud gas, Br2
berwujud cair, dan I2 berwujud padat. Untuk titik didih dan titik
lebur dapat dilihat pada tabel berikut.
b) Bentuk molekul (kerumitan)
Telah dibahas bahwa gaya antarmolekul bekerja lebih efektif pada jarak yang sangat
dekat. Aartinya, senyawa-senyawa yang bentuknya sederhana (kompak) akan
mempunyai gaya antarmolekul yang lebih kuat daripada yang bentuknya lebih rumit
(kompleks). Untuk lebih jelasnya perhatikan gambar dibawah ini.
Ikatan hidrogen adalah ikatan yang terjadi antara molekul-molekul yang sangat polar dan tentunya memiliki atom hidrogen. Ikatan hidrogen ini disebabkan oleh gaya tarik-menarik antara atom H dari satu molekul dengan atom yang sangat elektronegatif dari molekul lainnya. Atom-atom yang memiliki elektronegativitas tinggi adalah F, O, dan N. Ikatan ini lebih kuat dari ikatan van der Waals sehingga butuh energi lebih besar untuk memutuskannya, sehingga zat yang memiliki ikatan hidrogen memiliki titik didih dan titik leleh yang sangat tingg, seperti H2O, NH3, dan HF.
 |
| Source : https://images.app.goo.gl/1WGVtvHeaUE6JEC6A |
Seperti yang telah dijelaskan pada gaya van der Waals, titik didih dipengaruhi oleh massa molekul. Dari CH4 sampai SnH4 seiring dengan bertambahnya massa molekul, titik didihnya juga bertambah. Hal ini disebabkan tidak adanya ikatan hidogen dari keempat hidrida golongan IVA.
Seiring dengan kenaikan massa molekul, harusnya titik NH3 adalah yang paling kecil titik didihnya, namun, ternyata titik NH3 lebih tinggi dari pada titik didih didih PH3 dan AsH3 yang punya massa molekul lebih besar. Hal ini menunjukkan ada penyimpangan titik didih hidrida golongan VA.
Seiring dengan kenaikan massa moleku, harusnya H2O punya titik didih terendah. Ternyata titik didih H2O malah yang paling tinggi.
Seiring dengan kenaikan massa molekul, harusnya HF punya titik didih terendah. Faktanya HF punya titik didih paling tinggi.
Nah, penyimpangan mulai terjadi di golongan VA, VIA, dan VIIA, masing-masing pada senyawa NH3, H2O dan HF. Tingginya titik didih ketiga senyawa ini disebabkan pada molekul-molekul terjadi ikatan hidrogen yang lebih kuat pengaruhnya daripada gaya van der Waals (gaya van der Waals ada pada senyawa kovalen polar dan non-polar). Hal ini tidak berlaku pada senyawa CH4 dimana tidak terjadi ikatan hidrogen pada molekulnya (elektronegativitas C cukup kecil dibanding F, O, N) sehingga titik didihnya lebih rendah dari senyawa hidrida segolongannya. Tingginya elektronegativitas F, O, N membuat atom-atom ini mampu mengikat atom hidrogen dari molekul lain. Namun perlu diingat bahwa ikatan hidrogen tidak hanya terjadi pada NH3, H2O dan HF saja, tetapi bisa terjadi pada setiap senyawa yang mempunyai ikatan N – H, O – H, dan F – H, seperti senyawa-senyawa alkohol (metanol, etanol, propanol) dan senyawa-senyawa asam karboksilat seperti asam asetat.
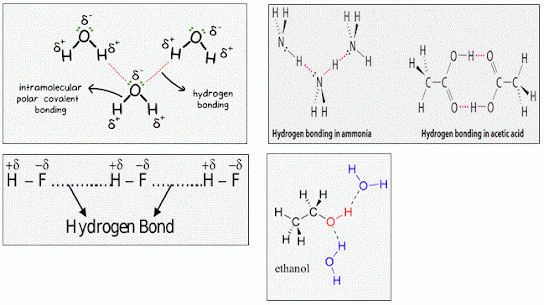 |
| Ikatan Hidrogen |
5NChemistry










Sangat bermanfaat sekali kak!! Terimakasihh!!
BalasHapusSama-sama, silahkan di share ya blog ini. https://semawur.com/go4T1amlVYON
Hapus