Molaritas, Molalitas, dan Fraksi Mol (Part -2)
Cara Menghitung Molaritas, Molalitas, dan Fraksi Mol.
Disamping persen dan bpj (bagian per juta) juga dikenal satuan kimia lainnya yaitu Molaritas, Molalitas dan Fraksi Mol. Pemahaman ketiganya sangat membantu dalam memahami pemeblajaran materi sifat koligatif larutan. Nah, mari perhatikan penjelasannya satu persatu.
Molaritas (M)
Molaritas menyatakan banyaknya jumlah mol zat terlarut dalam 1000 mL (1 liter) larutan. Bila dituliskan dalam bentuk rumus menjadi:
Keterangan
:
M
= molaritas
n
= mol
Mr
= massa molekul relatif zat terlarut (g/mol)
V
= volume larutan
Contoh
Soal.
1.
Tentukanlah kemolaran larutan berikut.
a). 0,5 mol urea dalam 2 liter larutan
b). 0,2 mol NaOH dalam 400 mL larutan
c). 12 gram urea (CO(NH2)2)
dalam 2 liter larutan
d). 1,5 gram asam cuka, CH3COOH
dilarutkan dengan air hingga volumenya 100 mL
e). 3,7 gram Ca(OH)2 dalam 200
mL larutan
2.
Hitunglah massa zat-zat berikut.
a). urea yang terdapat dalam 200 mL larutan
urea 0,4 M.
b). asam sulfat (H2SO4)
yang terdapat dalam 200 mL larutan asam sulfat 0,5 M.
c). garam dapur, NaCl yang terdapat dalam
400 mL larutan NaCl 0,25 M.
Pembahasan.
1.
a). M =
n/V(L) = 0,5/2 = 0,25 M
b).
M = n/V(L) =
0,2/0,4 = 0,5 M
c).
M = massa / Mr
x 1000/V (mL)
= 12 /60
x 1000/2000
= 0,1 M
d).
M = massa /Mr x
1000/V (mL)
= 1,5 /60
x 1000/100
= 0,25 M
e).
M = massa /Mr
x 1000/V (mL)
= 3,7/74
x 1000/200
= 0,25 M
2.
a). M =
massa /Mr x 1000/V (mL)
0,4 = massa
/60 x
1000/200
massa = 4,8 gram
b).
M = massa /Mr x
1000/V (mL)
0,5 = massa
/98 x
1000/200
massa = 9,8 gram
c).
M = massa /Mr x
1000/V (mL)
0,25 = massa
/58,5 x
1000/ 400
massa = 5,85 gram
Molalitas
(m)
Molalitas menyatakan banyaknya jumlah mol zat terlarut dalam 1 kg pelarut. Bila dituliskan dalam bentuk rumus menjadi :
Keterangan
:
m
= molalitas
n
= mol
Mr
= massa molekul relatif zat terlarut (g/mol)
P
= massa pelarut
Contoh
Soal.
1.
Hitunglah kemolalan larutan berikut.
a).
3 gram urea dicampurkan dengan 200 gram air (Mr urea = 60)
b). 15 gram cuka dicampurkan dengan 100 gram air
c). larutan glukosa yang mengandung 12% massa
glukosa
d). larutan cuka yang mengandung 24% massa CH3COOH (Mr cuka = 60)
2.
Hitunglah kadar (% massa) glukosa dalam larutan glukosa 1 molal (Mr glukosa =
180)
Pembahasan:
1.
a). m = 3/60 x 1000/200
=
0,25 molal
b).
m = 15/60 x 1000/100
= 2,5 molal
c).
glukosa = 12/100 x 100 gram = 12
gram
air = 100 – 12 = 88 gram = 0,088 kg
mol glukosa = 12/180 = 0,067 mol
m
= 0,067/0,088
= 0,76
mol/kg
d). cuka = 24/100 x 100 gram = 24 gram
air = 100 – 24 = 76 gram = 0,076 kg
mol cuka = 24/60 = 0,4 mol
m =
0,4/0,076
= 5,26
mol/kg
2.
Larutan glukosa 1 molal terdapat glukosa 1 mol dan air sebanyak 1 kg (1000
gram)
Massa glukosa = 1 x 180 = 180 gram
% massa glukosa = 180 / (180+1000) x 100%
= 15,25%
Fraksi
Mol (X)
Fraksi mol menyatakan perbandingan jumlah mol zat terlarut atau pelarut dibagi jumlah mol larutan. Jika jumlah mol zat pelarut adalah np, dan jumlah mol zat terlarut adalah nt, maka fraksi mol pelarut dan zat terlarut adalah :
Jumlah fraksi mol pelarut dengan zat terlarut adalah 1.
Contoh
Soal.
1. Hitunglah fraksi mol zat berikut.
a). urea dalam larutan urea 20% (Mr urea = 60)
b). urea dalam larutan urea 2 molal
c). 10 gram NaOH (Mr = 40) dicampurkan dengan 180
gram air
2. Tentukan kadar larutan glukosa, jika
diketahui fraksi mol glukosa sebesar 0,2
Pembahasan.
1. a).
massa urea = 20/100 x100 gram = 20 gram
mol urea = 20/60 = 0,33 mol
massa air = 100 – 20 = 80 gram
mol air
= 80/18 = 4,44 mol
Xt = 0,33/(4,44 + 0,33) = 0,07
b).
Dalam larutan urea 2 molal terdapat 2 mol urea dan 1 kg (1000 gram air)
mol air
= 1000/18 = 55,55 mol
Xt =
2/(55,55+2) = 0,035
c).
mol NaOH = 10/40 = 0,25 mol
mol
air = 180/18 = 10 mol
Xt = 0,25/(10 + 0,25) = 0,024
2. Fraksi mol glukosa (Xt = 0,2 atau 1/5)
1/5 = 1/(1 + 4)
Jadi, didapat mol glukosa = 1 mol, dan
mol air = 4 mol
massa glukosa = 1 x 180 = 180 gram
massa air = 4 x 18 = 72 gram
Kadar glukosa = 180 / (180 + 72) x 100% =
71,43%
Bagaiamana, mudah bukan?
Demikianlah
pembahasan tentang molaritas, molalitas dan fraksi mol. Semoga dapat menambah
pengetahuan kalian terutama buat kalian yang sedang mempelajari materi ini.
Terima kasih.
5NChemistry


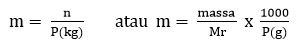
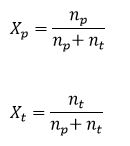
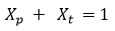





Posting Komentar untuk "Molaritas, Molalitas, dan Fraksi Mol (Part -2)"
Yuk....Mari berkomentar dengan bijak.